多溴联苯醚(PBDEs)是一种阻燃剂,广泛用于塑料制品、纺织品及电子电器产品中。这种物质持久性强,不易分解,可在生物体内积聚,是环境中广泛存在的全球性有机污染物。多溴联苯醚是人类活动产生的化学品,通常作商业用途的主要有五溴联苯醚、八溴联苯醚和十溴联苯醚等。多溴联苯醚普遍存在于环境中,具有潜在毒性。动物研究显示,多溴联苯醚会影响大脑和生殖器官、神经行为的发育及甲状腺素的水平,并会损害肝脏[1] 。人类主要从室内空气、家居灰尘和食物摄入多溴联苯醚,由于多溴联苯醚会影响人类健康和环境,因此备受关注。
欧盟最早禁用 PBDEs,早在 2003 年颁布了《电子电气设备中限制使用某些有害物质的指令》(ROHS),五溴联苯醚被明令禁止使用,并在 2008 年 4 月对十溴联苯醚产品实施禁用 [2] 。2009 年 5月,联合国环境规划署正式将四溴联苯醚、五溴联苯醚、六溴联苯醚和七溴联苯醚列入《斯德哥尔摩公约》。我国自 2014 年 3 月 26日起,禁止生产、流通、使用和进出口四溴二苯醚和五溴二苯醚、六溴二苯醚和七溴二苯 [2] 。
目前,检测多溴联苯醚(PBDEs)的方法主要有:GC-ECD[3] 、GC-EI/MS [3] 、GC-NCI/MS [5-8] 、HRGC-HRMS [3] 、GC-EI-MS/MS[9-11] 。GC-NCI/MS 是目前测定 PBDEs 最为常用的检测技术,除此之外,GC-EI/MS、HRGC-HRMS、GC-EI-MS/MS 方法也有报道。由于 GC-EI/MS 其灵敏度不稳定且较低,现在基本上不选用该技术。GC-NCI/MS,NCI 被称为“软电离源”,对含电负性基团的物质具有高选择性和高灵敏度,而对许多非电负性干扰物质没有响应。由于需要使 用 甲 烷 气 , 因此存在一定的危险性 。HRGC/HRMS 克服了 GC-EI/MS 灵敏度不高的问 题 , 灵敏度与 GC-NCI/MS 相当或高于GC-NCI/MS,但仪器价格昂贵,在基层实验室难以普及。近年来,多级质谱技术的应用,大大提高了 EI 源的灵敏度 。 国 内也有采用GC-EI-MS/MS 的报道,由于 GC-EI-MS/MS 能够在离子检测前排除样品基质中的干扰成分,且可将样品前处理过程中的共流物产生的干扰离子从离子阱中排除,该结果比 GC-EI/MS 的可信性和准确度更高,符合痕量 PBDEs 残留的分析要求。目前 GC-EI-MS/MS 方法同时检蛋及其制品中 16 种 PBDEs 残留的研究则尚未见报道。
本研究采用快速溶剂萃取和 SPE 净化的前处理方法提取 、 净化样品 , 并通过GC-MS-MS 检测样液,建立了测定蛋及其制品中 16 种多溴联苯醚类持久性有机污染物残留的测定方法。该方法准确、灵敏度高,适合多溴联苯醚残留的检测。
1、材料与方法
1.1 仪器与试剂
7000C 气相色谱 – 质谱 / 质谱,配有 7890气相色谱:安捷伦公司产品;E-916-4 快速溶剂萃取仪、Syacore R-12 平行蒸发仪:瑞士步琦公司产品;ALPHA 1-2 LD 冷冻干燥机 : 德 国Christ 公司产品;Turbo Vap LV 氮吹浓缩仪:美国 Caliper 公司产品;KQ-5200DE 水浴超声波仪:中国昆山舒美超声仪器有限公司产品;标准品 : 多溴联苯醚混标(BDE-17、BDE-28、BDE-47、BDE-66、BDE-71 、BDE-85、BDE-99、BDE-100、BDE-138、BDE-153、BDE-154、BDE-183、BDE-190、BDE-209), 单 标(BDE-206、BDE-207),内标(BDE-77、BDE-209-13C),购自美国 CIL 公司;二氯甲烷、正己烷、壬烷均为色谱纯:均为美国斯百全公司产品;实验用水为超纯水:产自美国密理博公司 Elix5 纯水机;无水硫酸钠,均为分析纯,是广州化学试剂厂产品;活性硅胶、碱性氧化铝柱吸附剂:为博纳艾杰尔公司产品。
酸性硅胶 SPE 柱:用正己烷湿法装柱(玻璃柱内径为 1 cm),从下到上依次为 2 cm 无水硫酸钠,5 cm 酸性硅胶,1 cm 无水硫酸钠。使用前10 mL 正己烷活化。
碱性氧化铝 SPE 柱:用正己烷湿法装柱(玻璃柱内径为 1 cm),2 cm 碱性氧化铝,1 cm 无水硫酸钠。使用前 5 mL 正己烷∶二氯甲烷(1∶1,V/V)和 10 mL 正己烷活化。
标准溶液:用壬烷配制 16 种标准样品的标准储备混合溶液,质量浓度为 1.0 μg/mL,保存于 4℃下,有效期为 6 个月。分析前用甲醇稀释到所需浓度。混合标准工作液:用上述标准溶液根据需要配制混合标准工作液。
1.2 前处理方法
1.2.1 冷冻干燥
将样品匀浆后,称取 10.0 g(精确至 0.01g),放入冷冻干燥机里冻干,冻干温度为-55℃,真空度为 0.02 mbar,冻干时间为 24 h,将冻好的样品放入密封袋中于干燥器中保存。
1.2.2 提取
将冻干样品粉碎成粉末,加入内标和 2.0 g(精确至 0.01 g)硅藻土混匀后装入 40 mL 的快速溶剂萃取池中。以正己烷∶二氯甲烷 (1∶1,V/V) 混合溶剂,温度 100 ℃,压力1 500Pa,预热5 min,静态提取10 min,60%萃取池体积溶剂快速冲洗样品,氮气吹扫 120s,2 个循环条件进行加速溶剂萃取,收集全部萃取液于收集瓶中。
1.2.3 净化
加入 2 g 活化硅胶,震荡混匀后,于超声波水解 10 min,中间震荡 1 次,收集溶液,然后再用 10 mL 正己烷提取,重复 2 次,合并该提取液,将萃取液转入 100 mL 平行蒸发瓶中,40℃减压平行蒸发浓缩至近干,用 5 mL正己烷(1∶1,V/V) 溶解。
将上述 5 mL 样品溶液转移到从上至下串联的酸性硅胶柱和碱性氧化铝柱上,然后用 5mL 的正己烷清洗平行蒸发瓶,并转移到 SPE柱上。然后用 10 mL 正己烷冲洗酸性硅胶柱, 待冲洗完毕,移除该柱。用 5 mL 正己烷淋洗碱性氧化铝柱,用 10 mL 正己烷∶二氯甲烷 (1∶1,V∶V)洗脱并收集,过 0.22 μm 有机相滤膜。用氮气浓缩至约 100 μL,完全转移到进样瓶的内插管中,继续用微弱的氮气流吹至近干,加入10 μL 正己烷溶液,震荡混匀,上机待检。
1.3 测定方法
1.3.1 GC 参数设置
载气:高纯氦气;柱流速:1.2 mL/min;进样量:1 μL;标准不分流模式进样;加热器温度:280 ℃,总流量:24.2 mL/min ,隔垫吹扫量:3 mL/min;色谱柱:Agilent DB-5HT (15 m ×250μm, 0.1 μm);柱温程序:初温 100 ℃,保持1 min,以 40 ℃/min 速率升至 340 ℃,保持3 min。
1.3.2 质谱条件
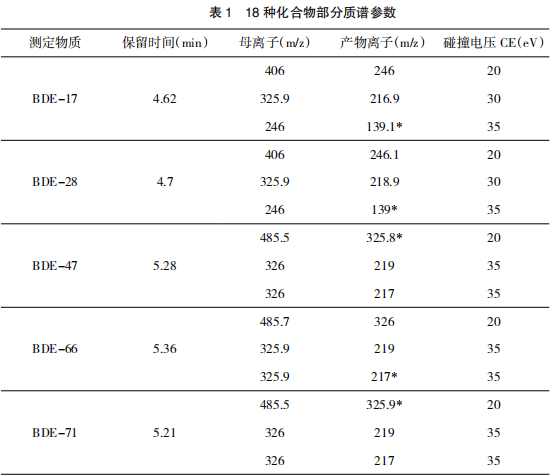
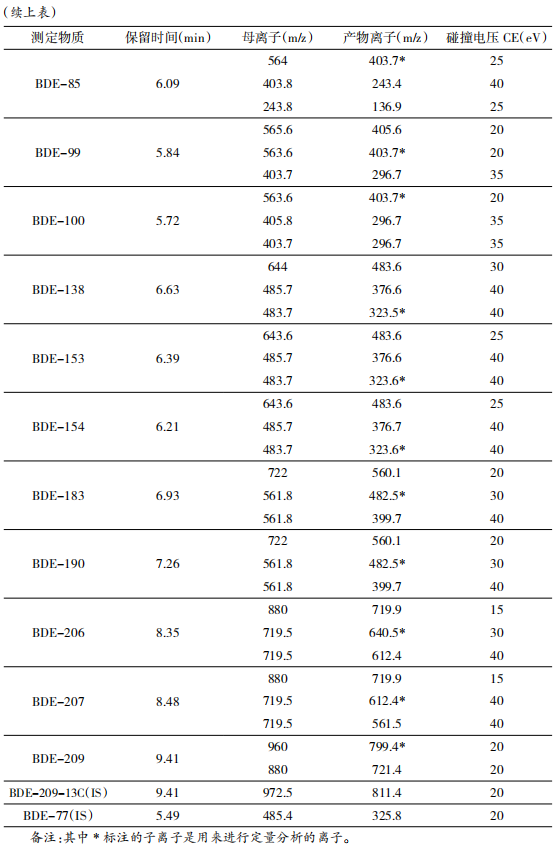
离子源类型:电子轰击离子源(EI),离子源温度:300 ℃,接口温度:340 ℃,分析器的温度:150 ℃,溶剂延迟时间:4.5 min,MS 离子源的电离电压为标准 70 eV;碰撞 (N 2 ) 气流速:1.5mL/min;淬灭气(He)流速:2.25 mL/min;MS 的离子检测模式为多反应离子监测(MRM),对应检测器电子倍增管的倍增系数为 10,详细 MRM参数见表 1,对应的总离子流图(TIC)见图 2。
2、结果与讨论
2.1 色谱条件的优化
对气相色谱柱的选择,比较了 DB-5MS(30 m × 0.25 mm, 0.25 μm) 与 DB-5HT(15 m ×0.25 mm, 0.1 μm)。采用 DB-5HT (30 m × 0. 25mm, 0.25 μm) 气相色谱柱进行色谱分离时,该组分的出峰时间稳定、分离度和峰形较好,且耐受性更好。多溴联苯醚类的沸点为 310~425℃,在气相色谱柱上后出峰组分的响应值比先 出 峰 的组分低较多 。 由于 BDE-206、BDE-207、BDE-209 的相对分子质量大,对温度比较敏感,高温下易发生降解,导致其在 30m色谱柱上的响应值较低,在 15m 的耐高温短气相色谱柱上,柱温最高可达 400 ℃,把柱温设置到 340 ℃,保持 3 min,出峰时间提早降低了其在色谱 柱上的降解,BDE-206、BDE-207、BDE-209 的响应值得到较大的提高。因而,选择 DB-5HT (30 m × 0. 25 mm, 0.25 μm) 气相色谱柱进行分离。
2.2 质谱条件的优化
根据目标化合物的分子质量和分子结构,选择 EI 源 SCAN 扫描模式进样,将浓度为1.0μg /mL 标准溶液用标准进样方式,进样量为1.0 μL,在 SCAN 模式下进行质谱分析扫描,PBDEs 一级 MS 图谱差异主要基于苯环取代溴的数量,对于三到八溴代 PBDEs, [M]+和[M-Br2]+ 是较强的离子峰,对于九和十溴代多溴联苯醚,[M]+ 和[M-Br2] + 也是较强的离子峰。在 MS 二级电离优化中,选取较强的 2~3 个产物离子作为母离子进行优化研究,[M]+ 在二级产物离子扫描中易形 [M-Br2] + ,优化碰撞能量(CE)。以丰度最高的离子定量离子,其他丰度比较低的 2~3 个离子碎片作为参比离子,进行定性和定量分析。最佳碰撞能量(CE) (见表 1)。
2.3 样品前处理条件的选择
2.3.1 提取溶剂的选择
目前国际上 PBDEs 测定的主要方法为美国环保局(U.S. EPA)方法 1614 [13] , 该方法借鉴于二 英方法,即采用索氏提取和层析柱净化的前处理方法与 GC-HRMS 的检测方法。本文参考该方法,同时考虑二氯甲烷为剧毒溶剂,选用提取溶剂为正己烷:二氯甲烷(1∶1, V/V)混合溶剂。
2.3.2 净化条件的优化
QuEChERS 方法的净化方式主要是分散固相萃取,通常使用的吸附剂有:NH 2 、PSA、C18、活性硅胶、中性氧化铝及石墨化炭黑(GCB)等。石墨化炭黑可去除提取液中的色素成分,但也会吸附目标化合物,不能在本实验中使用。NH 2吸附剂通常用于去除提取液中的弱酸性物质;C18 吸附剂、PSA 吸附剂 、中性氧化铝、活性硅胶都具有较强的除去脂肪的能力,蛋及其制品中含有丰富的蛋白质及脂肪类物质,实验发现C18 吸附剂 、PSA 吸附剂 、中性氧化铝对 16 种多溴联苯醚都有不同程度的吸附作用,所以选用活性硅胶吸附剂除去脂肪更合适。
酸性硅胶柱主要用于进一步去除脂肪,对于改善峰型至关重要。该柱对 PBDEs 的保留能力较差,实验调查表明 8 mL 的正己烷能达到86% 以上的洗脱效率,本方法采用 10 mL 正己烷洗脱。
由于多溴联苯醚类化合物结构中含有 O元素,在碱性氧化铝填料间有较强的氢键作用力而较好地保留,采用不同的试剂进行淋洗,能够使待测物在被洗脱之前去除非极性干扰物,而在被洗脱之后将极性干扰物保留。在上样后,用 10mL 正己烷将待测物从酸性硅胶柱上转移到碱性氧化铝柱上时未发现待测分析物流失,确保了酸性硅胶柱和碱性氧化铝柱能够串联使用,同时在该过程中非极性的干扰物通过正己烷的淋洗被去除;接着采用 10mL 二氯甲烷∶正己烷 (1∶1, V/V) 混合洗脱液洗脱待测分析物,其洗脱效率能够达到 90% 以上。
2.3.3 基质效应
基质效应包括基质增强效应和基质抑制效应。本文对基质效应进行了评价,基质效应可采用(基质匹配标准溶液所作曲线的斜率 / 无基质标准溶液所作曲线的斜率 – 1)×100 % 进行评价[13] 。结果表明几种化合物均存在不同程度的基质效应,且抑制效应多于增强效应。消除基质效应主要是改进样品净化方法,得到尽量干净的待测样液。除此之外,还有使用同位素内标低基质影响(同位素内标价格昂贵,不适合普遍使用)、多倍稀释待测样品液以降低基质效应成分浓度(需要高灵敏仪器,不适合本方法的测定仪器)、以空白样品待测液配制标准系列 (该方法简单有效,环保节约)等方法。综合考虑,本方法采用同位素内标和以空白样品待测液配制标准系列的方法,较好地消除了基质影响,满足16种多溴联苯醚检测的要求。
2.4 方法的检测限、回收率、重复性及线性范
围在以上确定的测定条件下,配制标准系列(n=6),分析化合物的浓度比为 X 轴,以分析化合物的峰面积比为 Y 轴绘制标准曲线。结果表明,PBDEs 各单体在各自的浓度范围内,线性关系良好,其相关系数和回归方程见表 2。
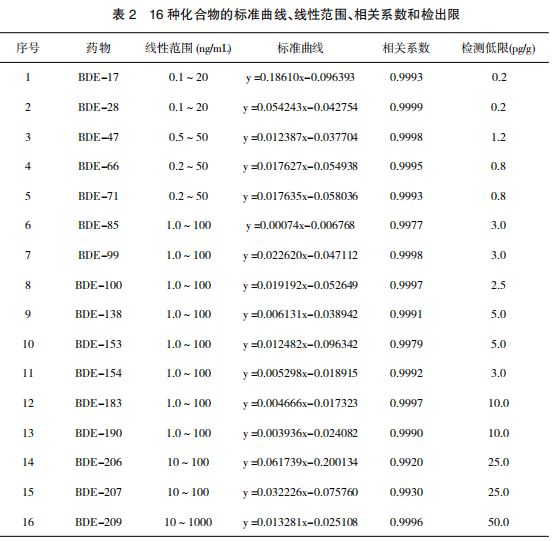
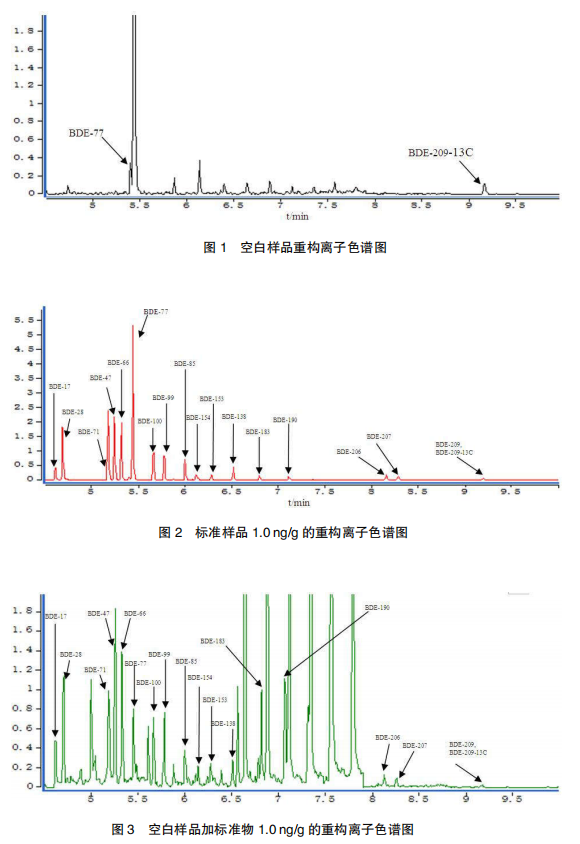
在空白样品中添加 16 种目标化合物标准溶液,定量内标 BDE-77 的质量浓度均为 20ng/mL,同位素内标 BDE-209-13C 质量浓度均为 200 ng/mL。进行 3 个水平浓度添加回收试验,每个浓度做 6 个重复。在本方法所确定的实验条件下,回收率和变异系数分别为 67.5%~112.2%和 2.6%~16.3% 。本方法对蛋及其蛋制品中 16 种目标化合物的检测低限为 0.2~50pg/g。图谱见图 1~3。
2.5 样品测定结果
采用本实验建立的方法测定了市场上采购的 10 个鸡蛋 和 10 个咸蛋样品。结果显示 20批样品中 ΣPBDEs 按湿重含量范围为 104.3~2529.2 pg/g ,中位数为 529.2 pg/g。
3、结论
本文采用快速溶剂萃取技术提取,利用QuEChERS 方法结合 SPE 净化样品,建立了蛋及其蛋制品中16 种多溴联苯醚残留的GC-MS/MS 检测方法。该方法快速准确、灵敏度高,适合 16 种多溴联苯醚残留的检测。经方法学验证,蛋及其蛋制品中 16 种多溴联苯醚浓度在 0.01~10.0 ng/L 范围内呈现良好的线性关系 ,r >0.99; 样品平均回收率为 67.5% ~112.2%;相对标准偏差为 2.6%~16.3%;方法检出限为 0.2~50 pg/g。本方法简便、可靠、检测种类多样,能满足监控的要求,便于使用该检测方法进行蛋及其蛋制品中多溴联苯醚残留的监测和有关人体摄入多溴联苯醚的健康风险评估。
参考文献
[1] 李子扬,陈永亨.多溴联苯醚的环境行为及其生态毒理效应 [J]. 科学技术与工程,2011,11(1):97-105.
[2] 王森,黄红林,张淑贞,等.土壤 – 植物系统中多溴联苯醚(PBDEs) 的迁移与转化研究进展[J].环境化学,2014,33(10):1645-1654.
[3] 方旭辉,马长文,陈卫东,等.色谱法分析多溴联苯醚研究进展 [J]. 上海第二工业大学学报,2013,30(4):275-284.
[4] 王国光,张大海,杨丹丹,等.超声辅助碱解萃取-气相色谱-电子捕获检测器测定海洋沉积物中 8 种多溴联苯醚 [J]. 色谱, 2015,33(8):885-891.
[5] 江锦花,陈涛.超声萃取 – 气相色谱 – 质谱联用测定海洋沉积物中 39 种多溴联苯醚残留[J].分析化学研究报告,2009,37(11):1627-1632.
[6] 何雪芬,熊珺,王妙春,等.超声萃取 – 气相色谱质谱法测定环境和食品中多溴联苯及多溴联苯醚[J].现代测量与实验室管理,2014, (2):3-6.
[7]张入元,任明忠,张素坤,等.气质联用法检测水体中 27 种多溴联苯醚(PBDEs)的方法探讨[J].广东化工, 2011,37(211):143 -145.
[8] Lacorte S, Guillamon M. Validation of a pres-surized solvent extractionand GC-NCI-MS method for the low level determinationof 40 polybrominated diphenyl ethers in mothers’milk [J]. Chemosphere,2008, 73: 70-75.
[9] 张付海,陆光华,胡雅琴,等. 固相萃取 – 浓硫酸净化 – 气相色谱 / 三重四极杆串联质谱法测定水中的 8 种多溴联苯醚 [J]. 分析试验室,2013,32(8): 25-30.
[10] 张莉莉,彭淑女,赵汝松,等. 食品中多溴联苯醚残留的气相色谱 – 串联质谱分析方法研究[J]. 分析测试学报,2010, 29(6):603-607.
[11] 卢大胜,林元杰,冯超,等. GC-MS/MS 同时测定鱼样中 39 种多溴联苯醚[J]. 食品安全质量检测学报,2013,4(04):1124-1133.
[12] 刘斌, 张立实, 张建清, 等. 深圳市市售鱼类和禽蛋类食品中多溴联苯醚污染状况分析[J].中华预防医学杂志, 2011,13(2): 1068-1072.
[13] 罗辉泰,黄晓兰,吴惠勤,等. QuEChERS/ 液相色谱 – 串联质谱法同时测定鱼肉中 30 种激素类及氯霉素类药物残留 [J]. 分析测试学报,2011,30(12):1239-1337.
[14] US EPA, Method 1614 Brominated Diphenyl Ethers in Water Soil, Sediment and Tissue by HRGC/HRMS, August 2007, water.epa.gov/scitech/methods/cwa/bioindicators/up-load/2007_09_11_methods_method_1614.pdf
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中二英及二 英类多氯联苯的测定 同位素稀释 -高分辨气相色谱 / 高分辨质谱法(GB/T 28643-2012) [s]. 北京: 中国标准出版社, 2012.
[16] Labadie P, Alliot F, Bourges C, et al. Determi-nation of polybrominated diphenyl ethers in fish tissues by matrix solid-phase dispersion and gas chromatography coupled to triple quadrupole mass spectrometry: Case study on European eel (Anguilla anguilla)from Mediterranean coastal lagoons [J].Anal Chim Acta,2010, 675: 97-105.
作者:李忠,刘陆,蔡勤仁,薛良辰,杨素,蔡杰,凌芸辉,黄晶,黄宇腾(广东省珠海出入境检验检疫局,广东珠海519015)、
责任编辑:丁焕中







