鸭疫里默氏杆菌病(Riemerella anatipestiferdisease) 是由鸭疫里默氏杆菌 (Riemerella a-natipestifer,RV) 感染引起的一种接触性传染性疾病,又称为鸭传染性浆膜炎、新鸭病、鸭败血症、鸭疫综合征、鸭疫巴氏杆菌病等。该病主要侵害鸭等水禽类动物,临床表现主要为神经症状、纤维素性心包炎、肝周炎和气囊炎,2~7 周龄雏鸭受到的危害较严重,发病率可达 90%以上,死亡率高达 75%以上,给养鸭造成了严重的经济损失 [1] 。1932 年美国首次报道该病,我国于1982 年首次报道 [2] 。该病临床表现和病理变化与鸭大肠杆菌病、鸭沙门菌病类似,临床上难以做出鉴别诊断,且 RA 血清型多达 21 种,不同血清型之间无显著的交叉保护,更增加了诊断的难度。在众多的血清型中,外膜蛋白 A (Outermembrane protein A ,ompA) 是 RA 所共有的结构基因,具有种内相对保守性 [3] 。RA 传统检测方法有细菌分离 [4] 、凝集试验 [5] 、荧光抗体技术[6] 、琼脂扩散试验 [7] 、酶联免疫吸附试验(ELISA)[8] 、PCR [9] 和荧光定量 PCR 检测方法 [10] ,但这些检测方法各有缺点,或费时费力,或容易出现交叉反应,或检测敏感性不高,或对仪器设备和人员要求较高。为调查山东省 RA 的流行情况,笔者根据 GenBank 公布的 RA ompA 基因建立了 RA套式 PCR 检测方法,并用该法对采自山东省各地的 RA 疑似病料进行检测。
1、材料和方法
1.1 病毒株与病料
鸭疫里默氏杆菌(RA)、鸭源大肠杆菌、鸭源沙门菌、鸭源巴氏杆菌和鸭源金黄色葡萄球菌由本实验室保存,临床检测病料采自山东各地鸭场临床诊断为 RA 感染的脑、肝脏等组织。
1.2 工具酶及试剂盒
DL2000 DNA Marker、TaqDNA 聚合酶、pMD18-T、dNTPs载体等为大连宝生物工程有限公司产品,多功能 DNA 纯化回收试剂盒、高纯质粒小量制备试剂盒和细菌基因组 DNA 快速提取试剂盒为北京百泰克生物科技有限公司产品。
1.3 引物的设计与合成
根据 GenBank 中登录的 RA ompA 基因序列(HQ701137),利用 Primer Premier 5.0 软件设计合成了 2 对特异性引物,其中引物 Pl、P2 的扩增长度 470 bp,引物 P3、P4 的扩增长度为249bp。外侧引物序列为:P1:5′-CCGTTAT-GTTTCTACTCCAGT-3’, P2: 5′-GCTTTAAT-GCTCCTGTTGC-3’;内侧引物序列为:P3:5′-CGGATGGTGACGGTGTTC-3’,P4:5′-CCTAAC-CTTTGTATTCTGGAA-3’。引物由上海生工生物工程技术服务有限公司合成,用灭菌双蒸水溶解并配成 12pmol/mL 溶液,-20 ℃冰冻保存。
1.4 细菌基因组 DNA 的提取
按照百泰克细菌基因组 DNA 提取试剂盒说明书提供的方法进行操作,同时提取其他几种对照菌的 DNA 作为模板。
1.5 PCR 方法的建立
1.5.1 PCR 反应条件的优化
最适退火温度的确定:分别以 46℃、48 ℃、50 ℃、52 ℃、54 ℃、56 ℃、58 ℃、60 ℃的退火温度进行梯度 PCR 反应,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳退火温度。
最适模板浓度的确立:分别以 1μL、2μL、4μL、6μL、8μL、10μL 反转录 cDNA 为模板,保持其他试剂浓度及反应条件不变,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳模板浓度。
最适引物浓度的确立:在 20 μL PCR 反应体系中分别加入上下游引物,使引物的终浓度分 别 为 0.2μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L、1.0μmol/L、1.2μmol/L,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳引物浓度。
1.5.2 PCR 扩增反应
第一轮 PCR 扩增反应:按 20μL 体系进行,根据上述实验确定的最适模板浓度、最适引物浓度和最适退火温度,确定最佳 PCR 反应条件:0.2μL Taq DNA 聚合酶(5 U/μL),2.0μL10×buffer,2.0μL dNTP(2.5 mmol/L),上下游引物 P1,P2(12μM)各 1.0μL,DNA 模板 2μL,双蒸水补至 20μL。扩增条件为 95℃ 5 min,94℃ 30 s,54 ℃ 30s,72 ℃30s,35 个循环,最后72℃ 延伸 10 min。
第二轮 PCR 扩增反应:按 20 μL 体系进行,模板为第一轮的 PCR 产物 1 μL,2μL10×buffer,2μL dNTP(2.5 mmol/L),上下游引物 P3,P4(12μM)各 1.0μL,0.2μL Taq DNA 聚合酶(5 U/μL),双蒸水补足至 20μL。扩增条件为 95℃ 5 min,94 ℃ 15s,52℃ 15s,72 ℃ 15s,35个循环,最后 72 ℃ 延伸 10 min。
1.6 PCR 的特异性试验
分别提取 RA、鸭源大肠杆菌、鸭源沙门菌、鸭源巴氏杆菌和鸭源金黄色葡萄球菌的基因组DNA,用已建立的 nested-PCR 扩增,每次扩增反应同时设双蒸水阴性对照,扩增反应结束后进行凝胶电泳检测。
1.7 PCR 的敏感性测定
提取 RA DNA,用紫外分光光度计测定其含量,并依次做 l0 倍梯度稀释,每个稀释度取lμL 为模板,用引物 Pl 和 P2 进行 PCR 扩增,反应结束后进行凝胶电泳检测。以第 1 次 PCR产物为模板,用引物 P3 和 P4 进行第二次扩增,反应结束后进行凝胶电泳检测。
1.8 PCR 的重复性试验
用建立的套式 PCR 检测方法分别对 RA感染的 8 份阳性样品以及 5 份阴性样品重复检测 3 次,以验证本方法的重复性和稳定性。
1.9 临床样品的检测
取疑似送检病料 36 份,利用建立的套式PCR 方法进行检测。
2、结果
2.1 扩增产物的检测
第一轮扩增产物的预期大小为 470 bp,第二轮扩增产物的预期大小为 249 bp,其扩增产物的电泳结果见图 1。
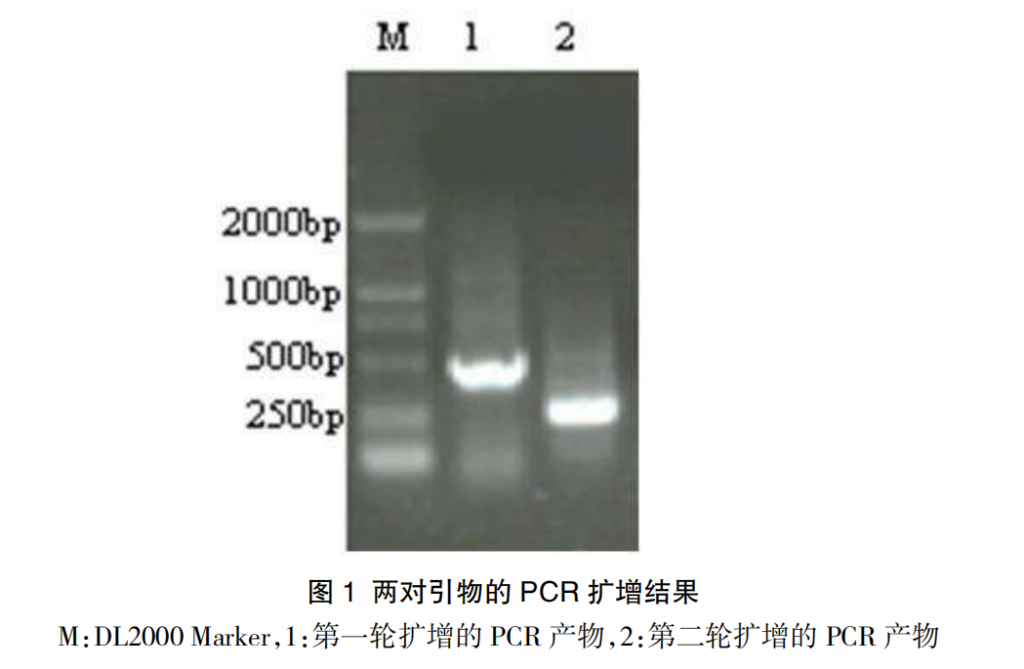
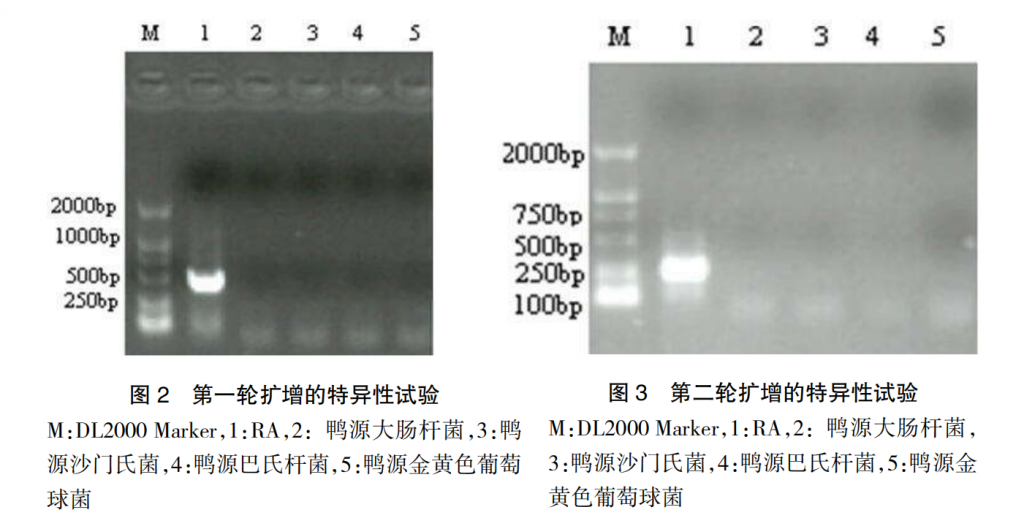
2.2 套式 PCR 的特异性试验
利用设计的第一轮引物对 RA、鸭源大肠杆菌、鸭源沙门菌、鸭源巴氏杆菌和鸭源金黄色葡萄球菌以相同的条件进行 PCR 扩增,琼脂糖凝胶电泳结果见图 2。取上述 PCR 产物各 1μL为模板,利用第二轮引物进行套式 PCR 检测,琼脂糖凝胶电泳结果见图 3。只有 RA 出现扩增产物,鸭源大肠杆菌、鸭源沙门菌、鸭源巴氏杆菌和鸭源金黄色葡萄球菌均未有扩增产物。
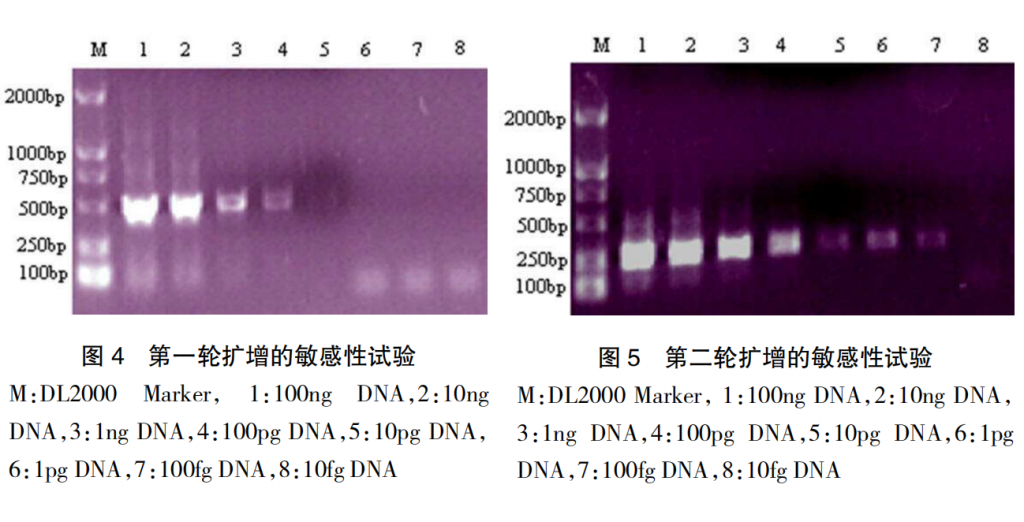
2.3 套式 PCR 敏感性试验
用紫外分光光度计测定的模板 DNA 浓度为 10 μg/mL。将提取的 DNA 依次做 10 倍梯度稀释,每个稀释度取 1μL,作为模板。用第一轮引物进行 PCR 扩增,结果显示第一轮 PCR 扩增的敏感性为 10pg(见图 4),以第 1 轮 PCR 产物为模板,用第 2 轮 PCR 引物进行第二次扩增,结果显示,第 2 轮 PCR 扩增的敏感性为100fg (见图 5)。表明第二次扩增的敏感性比第一次高 100 倍。
2.4 套式 PCR 重复性试验
经过 3 次重复操作,结果一致,表明本研究建立的方法是稳定可靠的。
2.5 临床样品的检测
对 36 份在不同地区采集的疑似病料,用建立的套式 PCR 检测方法进行了检测,利用第一轮 PCR 检测出阳性样品 19 份,而利用套式PCR 检测出 23 份阳性样品。对阳性样品的PCR 产物全部测序,进行序列分析,结果为鸭疫里默氏杆菌。
3、讨论
套式 PCR 是对常规 PCR 方法的改进,首先采用第 1 对引物对模板 DNA 进行第 1 轮扩增反应,再以第 1 轮扩增产物为模板,以第 2 对引物进行第 2 轮 PCR 扩增反应,从而降低了扩增多个靶位点的可能性,增加了检测的特异性,避免了样品检测过程中的假阳性问题。套式PCR 技术通过反转录产物的 PCR 和套式 PCR的二次扩增,大大提高了检测的灵敏度,避免了样品检测过程中的假阴性问题。因此,与常规PCR 相比敏感性更高,特异性更好,以达到检测微量模板的目的,已经广泛应用于多种畜禽疾病的检测中。套式 PCR 方法具有敏感性高、特异性强和快速高效等特点,为鸭疫里默氏杆菌病的早期诊断提供了新的模式。
本试验参考 GenBank 中已发表 RA ompA基因序列,设计合成 2 对特异性引物,建立了RA 检测的套式 PCR 检测方法,对退火温度优化,发现第 1 轮 PCR 的最佳退火温度为 54℃,第 2 轮 PCR 的最佳退火温度为 52℃,才能获得较为理想的产物,即使相差 2℃也不能获得理想的试验结果。对引物浓度进行优化,在引物浓度为 0.2~1.2μmol/L 对 PCR 扩增效率的影响不大,在 0.6μmol/L 时扩增效率相对较高,而在1.2μmol/L 时扩增效率相对较差。该方法只对RA 能够特异性地扩增出 249bp 的目的片段,而对 BVDV、BCV、CSFV 和 IRA 的扩增结果均为阴性,表明该方法具有良好的特异性。敏感性结果显示,第 1 次扩增的敏感性为 10pg,第 2 次扩增的敏感性达到 100fg,敏感性提高了 100倍。用建立的反转录套式 PCR 方法对来自山东各地鸭场送检的 36 疑似病料进行检测,利用第一轮 PCR 检测出阳性样品 19 份,而利用套式PCR 检测出 23 份阳性样品。将所有阳性样品的PCR 产物进行测序后,序列分析结果显示均是RA,说明建立的套式 PCR 检测方法更为敏感、特异,显示出了良好的应用前景。因此,本研究建立的套式 PCR 检测方法将为国内鸭疫里默氏杆菌病的诊断、流行病学调查等提供一种简单、快速的分子生物学诊断方法。
参考文献
[1] BW 卡尔尼克.禽病学(第 10 版)[M].高福,苏敬良,译.北京:中国农业出版社,1999:195-202.
[2] 郭玉璞,陈德威,范国雄,等.北京鸭传染性浆膜炎的调查研究[J].畜牧兽医学报,1982,13(2):107-112.
[3] 陈红梅,程龙飞,施少华,等.鸭疫里默氏菌环介导等温扩增检测方法的建立[J].中国农学通报,2010,26(20):15-17.
[4] 秦春雷,张大丙.鸭疫里默氏菌不同血清型在直接和间接荧光抗体试验中的交叉反应 [J]. 中国兽医杂志,2006,08:25-26.
[5] 张大丙,郭玉璞.北京地区鸭传染性浆膜炎的流行病学调查[J].中国预防兽医学报,1999,21(4):260-263.
[6] 苏文良,郭玉璞. 鸭疫里默氏菌 9 型的分离与鉴定[J]. 中国兽医杂志,2006,07:34.
[7] 张大丙. 用 3 种分型方法研究鸭疫里默氏菌的血清型 [J]. 畜牧兽医学报,2005,36(3):258-263.
[8] 李富祥,杨斌,常志顺,等.间接 ELISA 检测鸭疫里默氏杆菌血清抗体方法的建立[J].中国畜牧兽医,2010,37:202-206.
[9] 郭远奎. 鸭疫里默氏杆菌 PCR 快速检测方法的建立[J].家禽科学,11:6-8.
[10] 刘拂晓,李明义,范根成,等.鸭疫里默氏杆菌荧光定量 PCR 检测方法的建立[J].中国兽医学报,2010,30(6):756-761.
作者:于新友、李天芝(山东绿都生物科技有限公司,山东滨州 256600)
责任编辑:曹伟胜







