板蓝根为十字花科植物菘蓝 Isatisindigotica Fort. 的干燥根,呈圆柱形,稍扭曲,其性寒味苦,具有清热解毒、凉血利咽的功效,主治风热感冒、咽喉肿痛、口舌生疮和疮黄肿毒等症 [1] 。现代医学表明,板蓝根具有抗病毒、抗菌、抗内毒素、抗肿瘤和免疫调节等作用 [2] 。板蓝根中含有多糖类、生物碱类、黄酮类、氨基酸类及多肽、有机酸类及其衍生物、苯丙素类、含硫化合物芥子苷类、蒽醌类、甾体类等多种有效成分 [3] 。其中,板蓝根多糖类具有重要的生物活性功能。随着国内外学者对板蓝根多糖研究的深入,人们也逐渐意识到板蓝根多糖可能是板蓝根生物活性的主要作用因子之一 [4] 。许多研究证明板蓝根多糖对机体具有免疫调节功能。景晓平等 [5] 认为板蓝根多糖可以显著抑制 LPS 诱导THP-1 分泌 IL-1β 和 IL-6 的活性,促进 TIMP-2 蛋白的表达,从而进行免疫调节。板蓝根多糖还可以对油抑制大鼠亢进,提升大鼠的免疫功能,对环磷酰胺造模大鼠具有双向免疫调节作用 [6] 。除此以外,有研究报道板蓝根多糖对新城疫疫苗的免疫效果有明显的增强作用 [7] 。邱妍 [8] 等报道了低剂量的板蓝根多糖能显著提高新城疫 HI 抗体效价,促进外周血 T 淋巴细胞增殖,提高 CD4+ 、CD8+T 淋巴细胞含量和CD4+ /CD8+值。周孟清等 [9] 研究板蓝根多糖对新城疫病毒的作用,认为板蓝根多糖有望开发成一种抗病毒饲料添加剂和免疫保护制剂。
中药多糖活性成分的释放量直接影响着其药效的发挥。因此,在开发中药资源时应选择合适的中药多糖提取工艺,以提升有效成分的提取率,提高中药疗效。目前,中药多糖的常用提取方法有超声波提取法、酶解法、水提取法、微波辅助提取法、酸提取法和碱提取法等 [10-11] 。本研究通过比较中药多糖常用的提取方法:水浸提法、超声波法和酶解法对板蓝根多糖的提取效果,并采用正交试验对板蓝根多糖最佳提取方法进行工艺优化,旨在为板蓝根多糖的开发利用提供理论参考。
1、材料与方法
1.1 药品与试剂
板蓝根,为佛山万山红中药饮片实业有限公司产品;无水葡萄糖对照品,批号:110833-200904,中国食品药品检定研究院,纯度为100%;纤维素酶,为上海源叶生物科技有限公司产品;水为纯化水;其他化学试剂均为分析纯。
1.2 仪器
TU-1901 紫外可见分光光度计(北京普析通用仪器有限责任公司),AUW120D 十万分之一分析天平(日本岛津),RV 10 Digital V 旋转蒸发仪(德国 IKA),HWS-24 电热恒温水浴锅(上海一恒科学仪器有限公司),G-060S 超声波清洗机 (深圳市歌能清洗设备有限公司),DHG-9070A 电热恒温鼓风干燥箱(上海申贤恒温设备厂),DFY-500 粉碎机(温岭市林大机械有限公司),LXJ-IIB 离心机(上海安亭科学仪器厂)。
1.3 板蓝根多糖提取方法
(1)水浸提法板蓝根药材经粉碎后过 24 目筛,准确称量板蓝根粉末 5g,按料液比 1∶20(g/mL)加入纯化水,置于 90℃水浴,提取 2 次,每次 2h,合并提取液,提取液经旋转蒸发仪浓缩到原提取液体积的 1/20 左右,用 3 倍量的95%乙醇醇沉,醇沉后离心,沉淀用纯化水配制成 100mL 的溶液,测定多糖含量。
(2)超声波法板蓝根药材经粉碎后过 24 目筛,准确称量板蓝根粉末 5g,按料液比 1∶20(g/mL)加入纯化水,在超声频率为 40 kHz,温度为 60℃,超声时间为 30 min,功率为 360W 的条件下,超声波提取两次,合并提取液,提取液经旋转蒸发仪浓缩到原提取液体积的 1/20 左右,用 3 倍量的 95%乙醇醇沉,醇沉后离心,沉淀用纯化水配制成 100mL 的溶液,测定多糖含量。
(3)酶解法板蓝根药材经粉碎后过 24 目筛,准确称量板蓝根粉末 5g,按料液比 1∶20(g/mL)加入纯化水,木瓜蛋白酶用量为 2%,置于60℃水浴,提取两次,每次 2 h,合并提取液,提取液经旋转蒸发仪浓缩到原提取液体积的 1/20左右,用 3 倍量的 95%乙醇醇沉,醇沉后离心,沉淀用纯化水配制成 100mL 的溶液,测定多糖含量。
(4)正交试验根据不同提取方法对板蓝根多糖提取效率的试验结果,以料液比(A)、超声时间(B)、超声温度(C)为考察因素,每个因素设计 3 个水平,以多糖含量和提取率作为考察指标,采用 L9 (33 )正交表进行试验(见表 1),筛选板蓝根多糖最佳提取工艺。
1.5 测定指标
1.5.1 板蓝根多糖含量测定
(1)对照品溶液的制备取无水葡萄糖对照品 60 mg,精密称定,置 100mL 容量瓶中,加水使溶解并稀释至刻度,摇匀;精密量取 5mL,置于 100mL 量瓶中,加水至刻度,摇匀,即得(每1 mL 含葡萄糖 30μg)。
(2)供试品溶液的制备精密量取供试品0.5mL,置 10mL 量瓶中,加水至刻度,摇匀,即得。
(3)测定法分别精密量取对照品溶液与供
试品溶液各 1 mL,分别置具塞试管中,各加 5%苯酚溶液 1 mL,摇匀,冲入硫酸 5 mL,摇匀,置沸水浴中加热 15 min,立即置冰水浴中冷却5 min,取出,放置至室温。同时做空白试验校正,照分光光度法 [1] ,在 490 nm 波长处分别测定吸收度,计算,即得。
1.5.2 板蓝根多糖提取率
板蓝根多糖提取率 = 板蓝根多糖含量×100 mL÷板蓝根投料量×100%
2、结果与分析
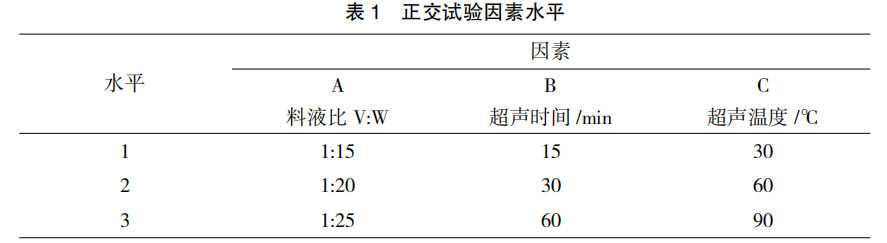
2.1 不同提取方法对板蓝根多糖的影响
采用不同提取工艺对板蓝根多糖提取效果如图 1 所示。在料液比为 1∶20 的条件下,超声波提取法对板蓝根多糖及其提取率最高,多糖含 量 和 提 取 率 分 别 达 到 3.386 mg/mL 和6.512%;其次是水浸提法,多糖含量和提取率分别达到 1.378 mg/mL 和 2.702%;最低是酶解法,多糖含量和提取率分别为 0.366 mg/mL 和1.661%。不同提取工艺对板蓝根多糖提取效果差异显著 (超声波法 > 水浸提法 > 酶解法,P<0.05)。
2.2 正交实验结果分析
根据不同提取方法对板蓝根多糖含量及提取率的影响结果,超声波提取法对板蓝根多糖及其提取率较高,因此采用超声波法进行板蓝根多糖提取的正交试验。以料液比(A)、超声时间(B)、超声温度(C)为考察因素,每个因素设计 3 个水平,以多糖含量和提取率作为考察指标,进行 L9(33)正交试验,筛选板蓝根多糖最佳提取工艺。正交试验结果如表 2 和图 2 所示。

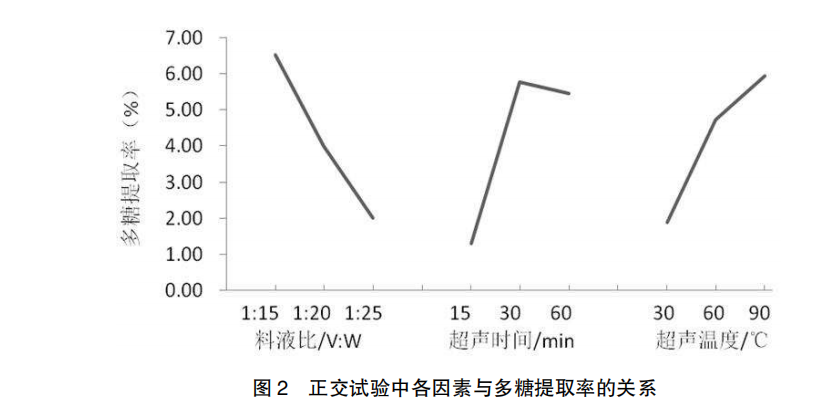
由表 2 直观分析可知,以板蓝根多糖含量及提取率为评价指标时,多糖含量极差 R 和多糖提取率极差 R’大小显示,各因素作用主次为料液比(A)> 超声时间(B)> 超声温度(C)。结合板蓝根多糖提取率的极差分析及图 2 中试验因素指标趋势可以看出,最佳工艺组合为 A1 B2 C3 ,即提取板蓝根多糖的最佳工艺参数为按料液比1∶20(g/mL)加入纯化水,在超声温度为 90℃,超声时间为 30 min 的提取条件下板蓝根多糖含量及提取率最高。
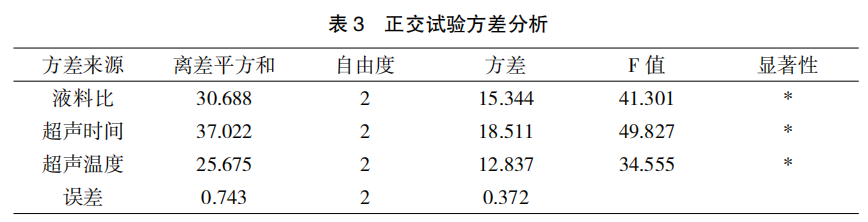
以板蓝根多糖提取率为考察指标的正交试验方差分析结果如表 3 所示。方差分析结果表明,料液比(A)、超声时间(B)和超声温度(C)对板蓝根多糖的提取率有显著影响(P<0.05),结合直观分析结果,得到板蓝根多糖的最佳提取工艺为:板蓝根药材经粉碎后过 24 目筛,准确称量板蓝根粉末 5g,按料液比 1∶20(g/mL)加入纯化水,在超声频率为 40 kHz,温度为 90℃,超声时间为 30min,功率为 360 W 的条件下,超声波提取两次,合并提取液,提取液经旋转蒸发仪浓缩到原提取液体积的 1/20 左右,用 3 倍量的 95%乙醇醇沉,醇沉后离心,沉淀用纯化水配置成 100mL 的溶液,测定多糖含量及提取率。
3、讨论
目前,植物多糖常用的提取方法有水浸提法、超声波法和酶解法等。本研究分别采用这3种方法提取板蓝根多糖,经比较发现超声波法的提取效果优于水浸提法和酶解法,多糖提取率分别提高了 3.810%和 4.851%,这说明板蓝根经过超声波的机械振动作用和“空穴作用”,破坏了植物细胞壁和细胞膜,有利于多糖的浸出,提高多糖的提取效率。水浸提法是传统的多糖提取方法,具有操作简便,提取纯度高等优点 [12] ,但水浸提法提取植物多糖往往需要时间比较长,温度较高,否则不能较好地破坏细胞结构,导致提取率较低。本试验中水浸提法的提取温度为 90℃,远高于超声波法和酶解法的提取温度,应用于大生产可能会导致耗能过高。酶解法是利用生物酶破坏细胞壁结构,促进有效成分溶出,使提取过程反应更温和,效率更高,在本试验条件下,酶解法对板蓝根多糖的提取效率不高,可能是酶的专一性问题。据张明等 [13] 报道,使用纤维素酶、果胶酶和胰蛋白酶组成的复合酶提取板蓝根多糖优于热水浸提法。
王丽萍 [14] 采用单因素考察的方法研究物料比、提取次数和提取温度对板蓝根总多糖得率和糖含量的影响,研究认为在物料比为 1∶20、提取温度为 100℃、提取 2 次的条件下,板蓝根多糖得率最高。本试验中水浸提法与上述研究结果的提取条件类似,但本试验通过对比不同的提取方法筛选出最佳提取方法,结果表明超声波法提取板蓝根多糖,设计正交试验得出板蓝根多糖提取的最佳工艺条件为:料液比 1∶20(g/mL),超声温度为 90℃,超声时间为 30min。陈奎等[15]分别采用超声波法、微波法和渗漉法提取板蓝根总多糖,结果表明超声法和微波法对板蓝根多糖提取完全,时间较短,但采用微波加热可能会破坏多糖的理化性质。本试验与陈奎等的研究结果均表明采用超声波法提取板蓝根多糖的效果优于其他提取方法。超声波法提取板蓝根多糖反应条件温和易控制,具有提取时间短、提取率高等优势,可为南板蓝根多糖的工业生产提供参考依据。
参考文献
[1] 中国兽药典委员会. 中华人民共和国兽药典2015年版二部[S].
[2]林丽君,聂黎行,戴忠,等.板蓝根的研究概况[J].中国药业,2015,24(21):1-4.
[3] 侯宪邦. 板蓝根潜在药效成分的发现及其作用机制的研究[D].南京:南京中医药大学,2017.
[4] 贾建,曹荣安,杜亿华,等.板蓝根多糖研究进展[J].食品工业科技,2016,37(18):378-383.
[5]景晓平,裴明,何丽.基于抗体芯片技术的黄芪多糖及板蓝根多糖免疫调节机制研究[J].中华中医药杂志,2013,28(11):3420-3423.
[6]张俊,胡安君,毕亚楠,等.板蓝根多糖对环磷酰胺造模大鼠的双向免疫调节作用[J].药物评价研究,2016,39(04):531-538.
[7]邱妍,胡元亮,董发明,等.板蓝根多糖对鸡新城疫疫苗免疫效果的影响[J].中国兽医学报,2008(07):753-756.
[8]邱妍,崔保安,胡元亮,等.4 种多糖对免疫雏鸡抗体效价和 T 淋巴细胞的影响[J].南京农业大学学报,2008(01):77-81.
[9]周孟清,张慧茹,贾峰,等.黄芪和板蓝根多糖的抗菌抗病毒作用研究[J].饲料工业,2014,35(21):58-64.
[10] ZHONGXK, JINX, LAIFY, et al.Chemical analysis and antioxidant activities in vitro of polysaccharide extracted from Opuntia ficusindica Mill. cultivated in China[J]. Carbohydrate Polymers,2010, 81(3):722-727.
[11]LAIFR, WENQB, LIL, et al. Antioxidant activities of water-soluble polysaccharide extracted from mung bean (Vigna radiata L.) hull with ultrasonic assisted treatment [J]. Carbohydrate Polymers, 2010, 812):323-329.
[12] 陈云. 菊花多糖的提取纯化及其活性研究[D].广州:华南理工大学,2015.
[13] 张明,李苗苗,卢惠.复合酶法提取板蓝根多糖工艺的研究[J].食品科技,2009,34 (11):208-211.
[14] 王丽萍.板蓝根多糖提取工艺的研究[J].黑龙江科技信息,2009(12):34.
[15] 陈奎,陈易彬.板蓝根多糖提取工艺的研究[J].食品研究与开发,2007(04):57-59.
作者:温馨1,2,温馨园1,2,刘汉清3,王甜3,李美娣1,2,涂玉蓉1,2,江耀伦1,2,武力1,2,3*(1.广州华农大实验兽药有限公司,广州510642;2.广东省兽用中药与天然药物工程技术研究中心,广州510642;3.华南农业大学,广州510642)
基金项目 :2017 年天河区科技计划项目, 项目编号(201708YG006);广州市珠江科技新星(Pearl River S&T Nova Program of Guangzhou)专项资助,项目编号(201806010096)
作者简介:温馨(1989-),女,硕士研究生,研究方向为新兽药开 发,E-mail:171034171@qq.com
* 通讯作者:武力(1970-),男,高级兽医师,博士研究生,研究方向为兽药学,E-mail:1187131629@qq.com
责任编辑:曹伟胜







