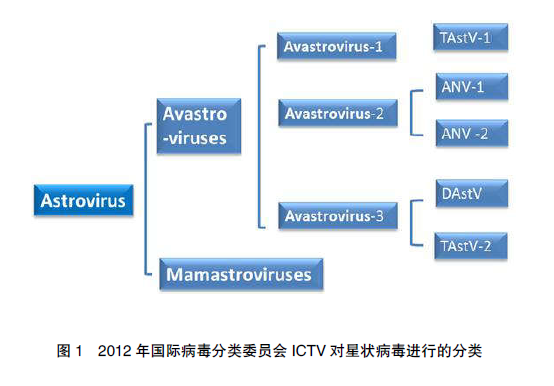
禽星状病毒(Avastrovirus)属于星状病毒科星状病毒属,是一种单股正链、没有囊膜的RNA 病毒,能够感染多种禽类。星状病毒粒子表面含有 5 个或 6 个突起结构,因呈现星状结构得名,典型的病毒直径 28~30nm,长度 6.8~7.9kb,呈 20 面体对称 [1] 。国际病毒分类委员会ICTV (http://www.iah-virus.org/astroviridae/) 将 星状病毒分为 2 个属:哺乳动物星状病毒属(Ma原mastrovirus)和禽星状病毒属(Avastrovirus)。其中禽星状病毒分为 3 种,分别是禽星状病毒 1型、禽星状病毒 2 型和禽星状病毒 3 型。禽星状病毒 1 型包括火鸡星状病毒 1 型(TAstV-1),禽星状病毒 2 型包括禽肾炎病毒 1 型(ANV-1)和禽肾炎病毒 2 型(ANV-2),禽星状病毒 3 型包括鸭星状病毒(DAstV)和火鸡星状病毒 2 型(TAstV-2)。其中,鸭星状病毒包括鸭星状病毒1 型(DHV-2)和鸭星状病毒 2 型(DHV-3) [2-4] (图1)。鸭星状病毒不同于其他的星状病毒,可以导致鸭致命性的病毒性肝炎。目前,有相关研究结果表明,已经出现鸭新型星状病毒,即鸭星状病毒 3 型和 4 型 [5-6] 。
1、禽星状病毒感染流行病学特点
1965 年,英国学者 Asplin [7] 发现了禽星状病毒,但是受限于当时的研究条件,初步认为该病毒属于小 RNA 病毒属的鸭肝炎 1 型病毒(DHV-1),并未将其命名为星状病毒。随后的研究发现,该病毒不能中和抗 DHV-1 的血清,于是上述猜测被推翻。之后,随着研究的深入,直到 1984 年,Asplin 再次发现,鸭肝炎 2 型的疫苗可以对鸭起到完全保护的作用,这一发现,对该星状病毒的分类起到了重要的作用。1985年,Gough 等 [8] 才将该病毒鉴定并命名为鸭肝炎病毒 2 型(DHV-2),确定为鸭星状病毒 1 型。而随后于 1969 年在美国发现的 DHV-3[9]直到2009 年才被确认为鸭星状病毒 2 型 [3] 。
禽星状病毒传播广,主要传染源是患病动物及带病毒动物,一般认为主要通过粪 – 口途径进行水平传播,食物和水可以作为星状病毒传播的载体。目前发现禽星状病毒已广泛分布于世界各地,既可以散发,也可以暴发流行。Bidin [10] 等首次从鹅胚和鸭胚中检测到 ANV,同时在鸭胚中发现了 TAstV-1,意味着禽星状病毒有可能经垂直传播传给新生雏禽,且存在跨物种传播的可能性。近些年也发现禽星状病毒出现重组现象,如 TAstV-2 发现了重组现象 [11-13] 。目前已经在鸡 [14] 、火鸡 [15] 、珍珠鸡 [16] 、鸭 [17] 、鹅 [18] 和鸽子 [19] 等禽类动物中检测出禽星状病毒,而且病毒宿主范围仍呈现扩大的趋势 [20] ,不同禽星状病毒感染的宿主有所差异。ANV 由于会导致间质性肾炎,会引起雏鸡的生长抑制 [21] 。鸭星状病毒不同于其他的星状病毒,3 周龄以内的雏鸭易感 [22] ,导致鸭致病性的病毒性肝炎症状 [7,8] 。
2、禽星状病毒基因组结构特点
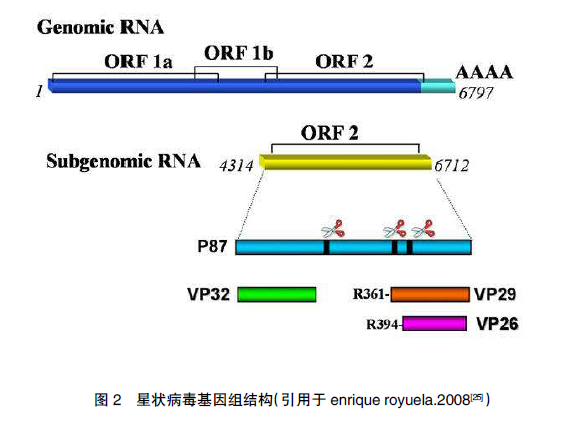
目前已有多种禽星状病毒基因组序列被测定 [23] 。星状病毒基因组包 括 1个 5’端非编码区 (UTR),3 个开放阅读框(ORFs), 即 ORF1a、ORF1b 和 ORF2,1 个 3’端非编码区(UTR)和 1 个 Poly(A)即多聚腺苷尾(图 2)。ORF1a 和 ORF1b 编码非结构蛋白,包括丝氨酸蛋白酶、几种跨膜螺旋结构、核定位信号(NLS)和 RNA 依赖性 RNA 聚合酶(RdRp)等。ORF2 编码结构蛋白,为衣壳蛋白编码区。禽星状病毒衣壳蛋白序列长度 671~743aa,对不同禽星状病毒的衣壳蛋白进行比较发现,N端较保守,且可能为病毒衣壳的核心装配区域,C 端变异较高,可能与病毒粒子表面形成的突起有关 [24] 。
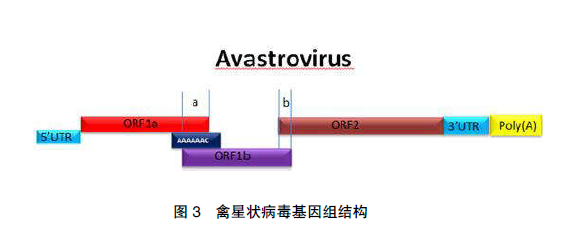
研究表明,不同禽类星状病毒的基因组结构中,存在一定的差异。核糖体读框移位机制的2 个基本要素是:第一,存在 XXXYYYZ 结构的移位序列,其中,X 和 Y 可以为相同的核苷酸;第二,下游的 RNA 序列有可能形成二级结构,如茎环状结构或者假结,预测可能翻译出两种不同的产物 [4] 。其中,图 3 所示禽星状病毒基因组结构简化图中,a 区符合核糖体读框移位机制的两个基本序列要素:当核糖体读码至滑动序列即 AAAAAAC 序列时,在其下游可能会形成二级结构。当形成柄环状二级结构时,阻碍了核糖体翻译的过程,核糖体发生移位到读码框架,从而避开了 ORF1a 区域的终止密码子的翻译,翻译出 ORF1a/ORF1b 的融合蛋白 RDRP,该蛋白可能由病毒或者细胞的蛋白酶切割而形成有活性的肽链 [26] 。如果未形成二级结构,则ORF1a 翻译至其终止密码子 UAG,从而仅翻译出 ORF1a 的产物。其次,不同禽类的星状病毒,在 a 区重合的核苷酸有所不同,ANV 下游重合19 个核苷酸,ORF2 和 ORF1b 保持同样的结构(图 3)。TAstV-1 和 TAstV-2 重合 18 个核苷酸,ORF2 和 ORF1b 保持同样的结构(图 3)。DAstV与其他星状病毒在基因结构中略有差异,a 区重合 23 个核苷酸,ORF2 和 ORF1b 结构不同,且不在同一个框架上,此外,DAstV 在 b 区含有1 个 19 个核苷酸的保守机制,有可能编码 1 个二级结构,除了 TAstV-2 外,其他的星状病毒均含有此结构。
目前多项研究发现,ORF2 编码产物至少包括两个区域:第一个区域为 1~415aa 位置附近,不同血清型之间该区域高度保守,第二个区域为 416aa 至结束,是高度变异的,经生物信息学软件分析,预测出中和抗原决定簇可能存在第二个区域,即 416aa 至结束 [20] 。
3、禽星状病毒感染的主要临床症状及对理化因子的抵抗力
Gough 等 [8] 通过试验证明,病雏鸭临床症状较为严重,常呈剧烈的角弓反张,剖检发现肝脏广泛出血,多数表现为肝炎病变,肾脏常肿大,在电镜下可观察到一种星状的病毒粒子。病禽通常 3 周龄左右发病并出现临床症状,一般可持续 10~14 天,临床症状主要表现为精神沉郁,下痢,生长发育迟缓,关节肿大,痛风,病理解剖可发现肾脏出现尿酸盐沉积。最新的研究发现 [27] ,鹅星状病毒感染中,最典型的临床症状是受感染雏鹅的体腔和关节内呈弥漫性尿酸盐分布。
在星状病毒对理化因子抵抗力的研究中发现,哺乳动物星状病毒对灭活剂的灭活作用有较强的抵抗力,同样,火鸡星状病毒也较为稳定 [28] 。经试验研究证实,星状病毒对大多数醇有抗性,病毒能够抵抗酸性 pH、氯仿、多种去污剂、热、室温和脂溶剂等的灭活作用 [29] ,90%的甲醇能灭活纯化的星状病毒和粪便中的星状病毒。
4、禽星状病毒感染临床检测方法
免疫电镜技术是鉴定和检测粪便和肠道样品中星状病毒的首选方法,也可用病毒分离、RT-PCR 对自然发病动物进行诊断。当前用单一 PCR 检测所有 HAstV 血清型已证明是可行的 [27] 。可以通过保守的核苷酸序列设计出特异性禽星状病毒的引物,用于可疑的感染动物样品的检测 [20] 。
针对星状病毒衣壳蛋白,建立的酶联免疫吸附试验(ELISA)和免疫荧光试验等也已经建立并应用。例如,2011 年,Wang [30] 等通过表达鸭星状病毒衣壳蛋白 C 段,建立了鸭星状病毒感染的 ELISA 检测方法。2012 年,Zhao [31] 等在鸡群中检测禽肾炎病毒感染中,克隆星状病毒抗原的衣壳蛋白基因并进行蛋白表达,获得融合蛋白之后建立 ELISA 方法,对临床样品进行检测,成功建立了 P1-ELISA 体系,在 960 份血清样本中,检测到 459 份(47.8%)为 ANV 感染阳性。
5、雏鹅痛风与禽星状病毒的关系
2016 年以来,我国各地陆续出现了以痛风症状为主的雏鹅疾病 [32] ,该病传染性强、传播范围广、发病率高、致死率高,给养鹅业带来了较大的经济损失。关于该病的主要病因是否为星状病毒感染,目前有待于深入研究。近年来,已有国内学者对雏鹅出现痛风症状进行了一系列的临床诊断及分析,夏伟斌 [33] 在常州市金坛区的 2 个厂区雏鹅发病情况调研中指出,鹅痛风的主要原因为长时间摄入蛋白质含量过高的饲料,导致肾功能下降,李凤莲等 [34] 同样指出雏鹅痛风是由于长期食用高蛋白饲料所致。传统的诊断方法,仅从营养、环境等方面对雏鹅痛风进行了诊治和分析,从临床诊断结果中来看,治疗效果较为明显,但是不排除该疾病会反复发作的可能,也不能排除星状病毒感染的可能。姜晓宁等 [35] 人在近期的研究中发现,导致雏鹅痛风的原因,主要为新型鹅星状病毒,并从山东、安徽、江苏、辽宁及河南等地采集的 143 份样品中,成功分离出星状病毒,且检出率高达96.5%。
6、关于禽星状病毒的研究
目前对人星状病毒的研究较为成熟,甚至已经出现商品化的检测试剂盒,但是对于禽星状病毒,因研究时间短,病毒难以培养的特性,还有众多需要研究的难点。如:星状病毒尚未进行血清型的明确分类。星状病毒因其感染特性,抑制宿主生长,因而很难用细胞进行繁殖培养,所以血清学分类困难,一般根据编码衣壳蛋白的 ORF2 的核酸和氨基酸的同源性推断[36] ;其次,尚未有足够的实验数据证明星状病毒是否能发生人和动物之间的重组 [37] ,目前有证据表明不同物种间的星状病毒存在抗原差异 [38] ,例如:猪星状病毒的抗体与牛星状病毒不反应,但是没有足够的实验数据证明,各星状病毒之间,能否发生重组;再如,星状病毒氨基酸所表达的某些特异性蛋白,如 ORF1a 末端翻译出的ORF1a/ORF1b 融合蛋白 RDRP,仅有数据证明,该蛋白可能由病毒或者细胞的蛋白酶切割而形成有活性的肽链,但具体的功能还需要进一步的研究验证 [26] 。
禽星状病毒对养禽业的经济影响程度还有待确定,而这类病毒是否也能感染包括人类在内的其他动物,是否具有公共卫生学意义,还需要进一步的探究。在现阶段,通过确定禽星状病毒抗原决定簇所在区域,并研究衣壳蛋白的共同特征,建立起一个系统、完整的各禽星状病毒之间的关系,以阐明禽星状病毒的传播和进化机制,进一步预测禽星状病毒的发展趋势,对预防禽星状病毒传播具有重要的理论意义与应用价值。
参考文献
[1] Suzanne M. Matsui, Jungsuh P. K I M, Harry B.Greenberg, et al.Cloning and Characterization of Human AstrovirusImmunoreactive Epitope[J].Jour-nal Of Virology,1993,67(3):1712-1715.
[2] D. Todd V J S N, Adair M. Identification of chicken enterovirus-like viruses, duck hepatitis virus type 2 and duck hepatitis virus type 3 as as-troviruses[J]. Avian Pathology,2009,38(1):21-29.
[3] Todd D, Wilkinson D S, Jewhurst H L, et al. A seroprevalence investigation of chicken astrovirus-infections[J].Avian Pathology,2009,38(4):301-309.
[4] Terry L. Lewis H B G J, Lucinda S. Smith A S M M. Analysis of Astrovirus Serotype 1 RNA, Identi-fication of the Viral RNA-Dependent RNA Poly-merase Motif, and Expression of a Viral Structural Protein[J].Journal Of Virology,1994,68(1):77-83.
[5] Bosch A, Pintó R M,Guix S.Human Astro-viruses [J].Clinical Microbiology Reviews,2014,27(4):1048-1074.
[6] Liao Q, Liu N, Wang X, et al. Genetic charac-terization of a novel astrovirus in Pekin ducks[J].Infection, Genetics and Evolution,2015,32:60-67.
[7] Asplin,F.D.Duck hepatitis [J].Vet,1965a,77,487-488.
[8] Gough R E, Borland E D, Keymer I F, et al. An outbreak of duck hepatitis type II in commercial ducks[J]. Avian Pathology,1985,14(2):227-236.
[9] Toth, T.E.Studies of an agent causing mortality among ducklings immune to duck virus hepatitis[J].Avian Diseases,1969.13(4):834-46.
[10] Bidin, M., et al.Astroviruses associated with stunting and pre-hatching mortality in duck and goose embryos [J].Avian Pathology,2012.41 (1):91-7.
[11] Pantin-Jackwood M J, Spackman E, Woolcock P R. Phylogenetic Analysis of Turkey Astroviruses Reveals Evidence of Recombination [J].Virus Genes,2006,32(2):187-192.
[12] Mendenhall I H, Yaung K N, Joyner P H, et al.Detection of a novel astrovirus from a black-naped monarch (Hypothymisazurea) in Cambodia[J].Virol-ogy Journal,2015, 12(1).
[13] Liu N, Wang F, Shi J, et al. Molecular charac-terization of a duck hepatitis virus 3-like astrovirus[J].Veterinary Microbiology,2014,170(1-2):39-47.
[14] Castro, C M O,Chagas E H N,Bezerra D A M,et al.First Whole-Genome Characterization of Avian Nephritis Virus 2 of Broiler Chicken from Pará,Brazil [J]. Genome announcements,2018.6 (25):e00510-18.
[15] Domanska-Blicharz K,Bocian L,Lisowska A,et al.Cross-sectional survey of selected enteric viruses in Polish turkey flocks between 2008 and 2011[J].BMC Veterinary Research,2017.13(1).
[16] De Battisti C, Salviato A, Jonassen C M, et al.Genetic characterization of astroviruses detected in guinea fowl (Numidameleagris) reveals a distinct genotype and suggests cross-species transmission between turkey and guinea fowl[J]. Archives of Vi-rology,2012,157(7):1329-1337.
[17] Liu N, Wang F, Zhang D. Complete sequence of a novel duck astrovirus [J].Archives of Virology,2014,159(10):2823-2827.
[18] Yang J,Tian J J,Tang Y,et al.Isolation and ge-nomic characterization of gosling gout caused by a novel goose astrovirus [J]. Transboundary and E-merging Diseases, 2018:1-8.
[19] Zhao W, Zhu A L, Yuan C L, et al. Detection of astrovirus infection in pigeons (Columbia livia) dur-ing an outbreak of diarrhoea [J]. Avian Pathology,2011,40(4):361-365.
[20] Jonassen C M, Jonassen T O, Saif Y M, et al.Comparison of capsid sequences from human and animal astroviruses [J].Journal of General Virology,2001,82(5):1061-1067.
[21] M. Narita S U K F. Pathogenicity of avian nephritis virus in chicks previously infected with infectious bursal disease virus [J]. Avian Pathology,1991,20:101-111.
[22] 于维军. 星状病毒研究进展[J]. 中国兽医杂志,1992,18(2):47-49.
[23] TadaoImada S Y M M. Avian Nephritis Virus(ANV) as a New Member of the Family Astroviridae and Construction of Infectious ANV cDNA[J].Jour-nal Of Virology,2000:8487-8493.
[24] Krishna N K. Identification of structural do-mains involved in astrovirus capsid biology[J].Vi-ralImmunol,2005,18(1):17-26.
[25] Royuela E, Sánchez-Fauquier A. Molecular cloning, expression and first antigenic characteriza-tion of human astrovirus VP26 structural protein and a C-terminal deleted form[J].Comparative Im-munology, Microbiology and Infectious Diseases,2010,33(1):1-14.
[26] Ernesto Me Ndez E S A C. Caspases Mediate Processing of the Capsid Precursor and Cell Re-lease of Human Astroviruses[J].Journal Of Virology,2004: 8601-8608.
[27] Niu X, Tian J, Yang J, et al. Novel Goose As-trovirus Associated Gout in Gosling, China[J].Vet-erinary Microbiology,2018,220:53-56.
[28] Brierley I.Ribosomal frameshifting on viral RNAs [J].Journal of General Virology,1995 (76):1885-1892.
[29] Schultz-Cherry S,King D J,Koci M D. Inacti-vation of an Astrovirus Associated with Poult En-teritis Mortality Syndrome Author(s) [J].Avian Dis-eases,2001,45(1):76-82.
[30] Wang X, Wang Y, Xie X, et al. Expression of the C-terminal ORF2 protein of duck astrovirus for application in a serological test [J]. Journal of Viro-logical Methods,2011,171(1):8-12.
[31] Zhao W, Zhu A L, Yu Y, et al. Segmentation expression of capsid protein as an antigen for the detection of avian nephritis virus infection in chicken flocks [J].Journal of Virological Methods,2012,179(1):57-61.
[32] Battisti C D,Salviato A,Jonassen C M, et al.Genetic characterization of a new astrovirus in goslings suffering from gout [J]. Archives of Virolo-gy, 2018.
[33] 夏伟斌. 鹅痛风病的病因分析与防治措施[J]. 中国畜牧兽医文摘,2018(04):170.
[34] 李凤莲,李家麟. 雏鹅痛风的诊治[J]. 中国兽医杂志,2018,54(1):60-61.
[35] 姜晓宁,田家军,杨晶,等. 导致雏鹅痛风新型鹅星状病毒的分离鉴定 [J]. 中国兽医学报,2018(05):871-877.
[36] Chu D K W, Poon L L M, Guan Y, et al. Novel Astroviruses in Insectivorous Bats[J]. Journal of Vi-rology,2008,82(18):9107-9114.
[37] Koci M D, Seal B S, Schultz-Cherry S. Molec-ular characterization of an avian astrovirus[J]. J Vi-rol,2000,74(13):6173-6177.
[38] Kurtz J B, Lee T W,Pickering A D,Astrovirus associated gastroenteritis in a children’s ward [J] Journal of Clinical Pathology,1977,30(10):948-52.
作者:王晓冰,施建鑫 ,罗开健(华南农业大学兽医学院,广州 510642)
责任编辑:曹伟胜







