禽流感病毒(Avian influenza virus,AIV)是一种能在家禽中流行并导致家禽感染发病的 A 型流感病毒,根据其对家禽致病能力的强弱分为高致病性禽流感病毒(HPAIV)和低致病性禽流感病毒(LPAIV)。H9 亚型禽流感病毒属于低致病性禽流感病毒,感染的鸡群不会引发鸡的死亡,但感染导致的产蛋率下降、生长速度减慢以及饲料利用率降低,也对养禽业产生了巨大的损失。H9 亚型禽流感的低致病性导致其关注度不高,虽然国内有 F 株、SS 株和 SD696 等 BJ/94 分支的疫苗株,也能达到一定的免疫效果,但是仍常有 H9 亚型禽流感的发生 [1-4] 。已有研究表明,2011~2013 年间我国新发 H7N9 亚型禽流感病毒的 6 个内部基因均来自于 H9N2 亚型禽流感病毒 [5,6] 。为了进一步加强对 H9 亚型禽流感病毒的检测,防止 H9 亚型病毒的广泛传播再次导致新发病毒的出现,笔者于 2017 年采集了广东珠三角地区某屠宰场鸡群的喉拭子和肛拭子,并分离到了 2 株 H9 亚型禽流感病毒。笔者对这 2 株病毒的 HA 基因进行了测序与分析,并将它们与近年来流行的 H9 亚型禽流感病毒和部分常用的疫苗株进行比较分析,旨在通过分析其分子特征的差异,了解目前流行于珠三角地区的 H9 亚型禽流感病毒的分子特点,为该病毒的防控和检疫提供一定的理论依据。
1、材料与方法
1.1 材料
1.1.1 样品采集
本样品病料采集于 2017 年珠三角地区某屠宰场鸡群的喉拭子和肛拭子。
1.1.2 试验动物
9~11 日龄 SPF 鸡胚由新兴大华农禽蛋有限公司 SPF 实验动物中心提供。
1.1.3 试验试剂
新城疫病毒、H5 RE-6、RE-7、RE-8、H7 和 H9 亚型禽流感阳性血清为哈尔滨维科生物技术开发公司产品,Fastagen 病毒 RNA 抽提试剂盒为上海飞捷生物技术有限公司产品,胶回收试剂盒购于 OMEGA 公司,M-MLV 反转录酶、Recombinant RNase Inhibitor、dNTP Mixture、5XReverseTranscription M-MLV Buffer、2X ExTaq酶、DL2000 DNA Marker、pMD-19T 载体为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 病毒的分离与传代
取喉、泄殖腔拭子,5 000 r/min 离心 5 min,上层清液用 0.22 滋m 滤器过滤除菌。取 0.2 mL滤液经尿囊腔接种 9~11 日龄的 SPF 鸡胚 5 枚,接种后置于 37℃恒温培养箱孵化,每 8h 照胚观察 1 次,弃去 24 h 之内死去的鸡胚。至 72 h,将所有鸡胚置于 4℃冰箱。收取鸡胚的尿囊液,5 000 r/min 水平离心 10 min,收上清进行无菌检查,然后连续传代 3 代。
1.2.2 血凝试验与血凝抑制试验
配置 1%鸡红细胞悬液,参照文献所述方法,取第三代鸡胚尿囊液进行血凝试验。挑选能够使鸡红细胞产生血凝的毒株的尿囊液分别与新城疫病毒、H5 RE-6、RE-7、RE-8、H7 和 H9亚型禽流感阳性血清进行血凝抑制试验。
1.2.3 病毒基因型的测定
1.2.3.1 引物的设计
参考文献[7]设计流感病毒反转录引物Unin12:5′-AGCAAAAGCAGG-3’,流感病毒HA 基因通用引物 HA_F tattcgtctcagggag-caaaagcagcagggg 和HA_Ratatcgtctcgtattagtagaaa-caagggtgtttt 由英潍捷基(上海)贸易有限公司合成,预计 PCR 扩增产物长度为约 1 700bp。
1.2.3.2 RT-PCR 反应和 PCR 产物回收
按照病毒 RNA 提取试剂盒说明书步骤从含有流感病毒的第三代鸡胚尿囊液中提取病毒总 RNA,并以 Unin12 为反转录引物,将总 RNA反转录成 cDNA,再使用 2X ExTaq 酶以及流感病毒 HA 基因通用引物进行 PCR 扩增。进行琼脂糖凝胶电泳,将预计位置的扩增条带切下,按照胶回收试剂盒说明书回收纯化 DNA。
1.2.3.3 载体的连接和序列的测定与分子特征分析
将上一步的回收产物与 pMD-19T 载体按比例混合,16℃反应 30min。将连接产物转入DH5α 感受态细胞,培养后经菌落 PCR 鉴定筛选阳性质粒,将菌液送至英潍捷基(上海)贸易有限公司进行序列测定。测序结果经 DNAstar软件包进行拼接后,将获得的序列提交 NCBIBLAST 进行联机检索。应用 DNAstar 软件包的MegAlign 程序中的 Clustal W 方法对病毒进行相似性比较,应用 MEGA 7 软件分析 HA 蛋白裂解位点的氨基酸序列、受体结合位点。潜在的糖基化位点用软件 NetOGlyc 4.0 Server(http://www.cbs.dtu.dk/services/NetOGlyc/)预测。
1.2.3.4 病毒 HA 基因的系统生成进化树分析
从 GenBank 上获取 F SS SD696 等疫苗毒株以及 H9 各分支的代表毒株 HA 基因的核苷酸序列,应用 MEGA 7 软件使用 Clustal W 方法将序列裁剪出全长 ORF 长度,设置其检验类型为自展法检验(Bootstrap Method)1 000 次重复构建邻接(Neighbor-Joining [NJ])进化树。
2、结果
2.1 病毒的分离与传代
将采集的喉、泄殖腔拭子接种 9~11 日龄的SPF 鸡胚,每枚接种 0.1 mL,每隔 12 h 观察鸡胚是否死亡,48 h 后收取鸡胚尿囊液再次接种鸡胚。以此方法连续盲传 3 代,第三代发现 72 h出现部分鸡胚死亡,将鸡胚 4℃冷冻,收取鸡胚尿囊液。尿囊液无菌检查显示为阴性。
2.2 血凝与血凝抑制试验
血凝试验结果显示,鸡胚尿囊液能够凝集鸡红细胞,93 和 101 2 株病毒的血凝效价(HA)分别为 1∶128 和 1∶256。同时用新城疫病毒、H5 亚型 RE-6、RE-7、RE-8、H7 亚型和 H9 亚型 AIV 标准阳性血清对其进行血凝抑制试验,发现上述血清对 93 毒株的血凝抑制效价(HI)分别为 <1∶2、<1∶2、<1∶2、<1∶2、<1∶2 和1∶64;对 101 毒株的血凝抑制效价为 <1∶2、<1∶2、<1∶2、<1∶2、<1∶2 和 1∶32。证明分离到的毒株为 H9 亚型的禽流感病毒。将此 2株病毒分别命名为 A/Chicken/Dongguan/93/2017和 A/Duck/Foshan/101/2017。
2.3 病毒 HA 基因的扩增
利用病毒 RNA 提取试剂盒从尿囊液中抽取病毒的 RNA,利用流感通用 HA 引物对其进行 RT-PCR 扩增。扩增后利用琼脂糖凝胶电泳试验对其进行电泳鉴定,发现扩增出 1 条1 700bp 左右的条带,与预期片段大小一致(图1)。将目的条带切下,并使用凝胶回收试剂盒回收目的条带。

2.4 病毒 HA 基因的测定及病毒分子特征分析
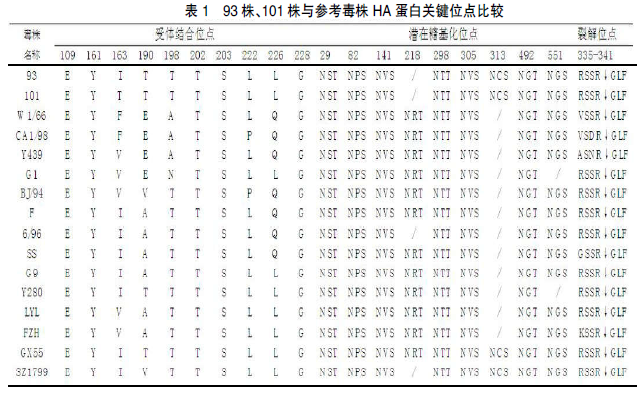
利用 DNAstar 软件包对测序结果进行拼接和分析。分析结果表明,此两株毒株的 HA 基因均含有长度为 1 683 个核苷酸的 ORF,预计能够编码成560 个氨基酸,2 株病毒的氨基酸同源性为 94.9%。NCBI BLAST 检索结果显示,93 毒株与 GenBank 上的 G2927 毒株相似性最高,核苷酸相似性为 98%;101 毒株与 GenBank 上的G3831 毒株相似性最高,核苷酸相似性为97.4%。对 2 株毒株受体相关位点进行分析(表1),93 毒株受体结合位点(H3 numbering)的氨基 酸 为 109E、161Y、163I、190T、198T、202T、203S、222L、226L 和 228G;101 毒株受体结合位点(H3 numbering)的氨基酸为 109E、161Y、163I、190T、198T、202T、203S、222L、226L 和228G,与 93 基本一致。有文献指出,H9N2 发生Q226L 突变会导致其对人类受体的结合能力增强。所以,本试验的 2 株 H9N2 的受体结合能力均表现为哺乳动物受体结合位点的特征。2 株毒株在裂解位点(335-341 位)的氨基酸序列为RSSR↓GLF,无连续性碱性氨基酸插入,所以仅能被有限的蛋白酶识别,符合低致病性禽流感病毒的分子特征。该 2 株病毒在网站预测的潜在糖基化位点一致 , 均 为 29NST、82NPS、141NVS、298NTT、305NVS、313NCS、492NGT 和551NGS。对比其他参考毒株潜在糖基化位点后发现,93 和 101 毒株在 218NRT 潜在糖基化位点消失,增加了 313NCS 位点的糖基化。此种变异的出现,预示目前流行的 H9 亚型 AIV 与早年间流行的病毒对宿主的作用方式可能发生了变化。
2.5 病毒遗传进化分析
系统生成 NJ 进化树结果表明(图 3),93 毒株和 101 毒株属于同一分支,均属于 H9.4.2.5分支。与此两株毒株亲缘关系最近的是 DG1674毒株,2 株毒株均独立形成一个小分支,说明目前在鸡群中流行的 H9 亚型 AIV 虽然仍然以H9.4.2.5 分支为主,但彼此间也有一定的遗传差异性。将它们与国内近年流行的 H9.4.2.5 分支的病毒的核苷酸和氨基酸序列进行比较,其核苷酸同源性分别为 93.1%~96.8%和 93.5%~96.6%;氨基酸同源 性为 93.6%~96.4%和94.3%~97.7%,相似性较高。国内常用的疫苗株:F 株、SS 株和 SD696 株,均属于 H9.4.2.3 分支毒株,与本试验分离到的 2 株病毒虽然同属于 H9.4.2 大分支,但其本身 2 个分支的毒株之间的遗传距离较远。93 毒株与国内常用的疫苗株 F 株、SS 株、SD696 株的核苷酸同源性分别为 88.2%、89.1%和 88.7%,101 毒株与 F 株、SS株、SD696 株的核苷酸同源性为 88.1%、89.3%和 89.0%;氨基酸同源性分别为 89.3%、89.5%和 89.1%,89.5%、90.2%和 89.7%。进一步说明该 2 株毒株与当前疫苗株之间存在较大的差异 [8,9] 。

3、讨论
本试验从采集的咽、肛拭子中分离到了 2株禽流感病毒,其能够与 1%的鸡红细胞发生血凝反应,并且此种血凝反应能够被 H9 亚型禽流感病毒标准阳性血清所抑制。测序结果表明,2 株病毒的 HA 基因的裂解位点序列为RSSR↓GLF,表现出典型低致病性禽流感病毒分子特征,证明 93 和 101 分离株均属于低致病性的 H9 亚型禽流感病毒 [10] 。
HA 基因是禽流感病毒重要的毒力基因,其主要功能为:识别靶细胞表面受体并与之结合;具有宿主细胞核融合活性;诱导保护性中和抗体的产生。同时,在禽流感病毒的研究中也经常将 HA 基因的进化作为研究手段来研究禽流感病毒的遗传进化情况。所以,对禽流感病毒的HA 基因进行分析,可以比较深入地了解病毒的致病性、宿主特异性、抗原性以及遗传演化情况。分析结果发现,2 株病毒以及近年的流行毒株 HA 蛋白受体结合区域 226 位氨基酸均发生了 Q→L 突变,表现出典型的人类受体结合特性,说明 H9 亚型禽流感病毒在进化的过程中正在提升其直接感染人和其他哺乳动物的能力,应当予以足够的重视。同时,与 F 株和 SS 株相比,此 2 株病毒以及同属 H9.4.2.5 分支的其他毒株均发生了 T220I、P315S 的突变,导致其潜在糖基化位点 218NRT 消失但增加了313NCS。目前我们无法证明此种变异是否对其抗原性、受体结合能力造成影响。病毒进化树分析结果可知,此 2 个毒株均属于 H9.4.2.5 分支。目前国内常用的疫苗毒株均属于 H9.4.2.3 分支,与本次分离到的 2 个毒株之间具有较大的遗传差异性。同时,核苷酸和氨基酸序列同源性分析结果也表明,93 毒株与国内常用的疫苗株 F 株 、SS 株、SD696 株的核苷酸同源性分别为 88.2%~89.1%和 88.1%~89.3%;氨基酸同源性分别为 89.1%~89.5%和 89.5%~90.2%,目前所使用的疫苗株可能对其无法产生 100%的保护力。
目前已有研究表明,养禽业相关人员为禽流感病毒高危易感人群。屠宰场屠宰密度巨大,工作环境复杂,在此种环境下工作应进一步做好疫病防控工作,以防止疫病的跨宿主传播。H9 亚型禽流感病毒目前表现出的人类受体结合能力增强的特性,可能会使其感染人特别是屠宰场员工,以及接触到禽肉制品人员的风险大大提升。所以,我们应该引起重视,进一步加强对屠宰场 H9 亚型禽流感病毒的监测与防控,将 H9 亚型的变异扼杀在摇篮里。
参考文献
[1]Wei, Y., et al., Antigenic evolution of H9N2 chicken influenza viruses isolated in China during 2009-2013 and selection of a candidate vaccine strain with broad cross-reactivity[J]. Vet Microbi-ol, 2016. 182: p. 1-7.
[2]Liu, Y.F., et al., Endemic Variation of H9N2 A-vian Influenza Virus in China[J]. Avian Dis, 2016.60(4): p. 817-825.
[3]Sun, Y., et al., Genotypic evolution and antigenic drift of H9N2 influenza viruses in China from 1994 to 2008 [J]. Vet Microbiol, 2010. 146 (3-4): p.215-25.
[4]Shen, H.Q., et al., Isolation and phylogenetic analysis of hemagglutinin gene of H9N2 influenza viruses from chickens in South China from 2012 to 2013[J]. J Vet Sci, 2015. 16(3): p. 317-24.
[5]Pu, J., et al., Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J]. Proc Natl Acad Sci U S A, 2015.112(2): p. 548-53.
[6]Yu, X., et al., Influenza H7N9 and H9N2 virus-es: coexistence in poultry linked to human H7N9 infection and genome characteristics [J]. J Virol,2014. 88(6): p. 3423-31.
[7]Hoffmann, E., et al., Universal primer set for the full-length amplification of all influenza A viruses[J]. Arch Virol, 2001. 146(12): p. 2275-89.
[8]Jiang, W., et al., Chinese and global distribution of H9 subtype avian influenza viruses [J]. PLoS One, 2012. 7(12): p. e52671.
[9]Liu, S., et al., Panorama phylogenetic diversity and distribution of Type A influenza virus [J]. PLoS One, 2009. 4(3): p. e5022.
[10] Lin, Y.P., et al., Avian-to-human transmission of H9N2 subtype influenza A viruses: relationship between H9N2 and H5N1 human isolates[J]. Proc Natl Acad Sci U S A, 2000. 97(17): p. 9654-8.
作者:叶小苌(深圳市光明新区动植物检验检测中心,广东深圳5181070)
责任编辑:任涛







